Genterapi är en avancerad form av läkemedel som används för att behandla genetiska sjukdomar. Vid den hittills mest använda formen av genterapi förs en ny gen in i patientens celler. Syftet är att den nya genen ska kompensera för en gen som är muterad på ett sätt som orsakar sjukdom. Det kan liknas vid en organtransplantation där genen är det nya organet.
Det finns andra former av genterapier, t.ex. CAR-T-cellterapier och genomredigerande behandlingar med tekniker som CRISPR/Cas.
Förhoppningar och bakslag när genterapier utvecklas
1970- och 1980-talen, idén om genterapi formuleras
Redan 1971 visade forskare för första gången att DNA kan injiceras i celler och där kompensera för en brist i cellen. Experimentet gjordes inte i en levande människa utan in vitro, det vill säga med celler som odlats i laboratorium.
Året därefter, 1972, myntades termen genterapi för första gången i en artikel i det vetenskapliga tidskriften Science och en förhoppning såddes om att man i framtiden skulle kunna bota i stort sett alla genetiska sjukdomar med genterapi.
Viktiga framsteg för genterapi: kloning av gener och virusvektorer
Två forskningsframsteg var avgörande för att forskare skulle försöka utveckla genterapier. Under 70-talet hade forskare lärt sig att klona gener vilket verkligen tog fart när PCR-metoden utvecklades som snabbt kunde föröka upp en specifik DNA-sekvens som till exempel en gen i många kopior.
Det andra framsteget var att forskare på 80-talet upptäckte att retrovirus kan transportera gener in i cellkärnan. Forskare lärde sig att avväpna viruset och ta bort gener som viruset behöver för att spridas och orsaka sjukdom. Istället klistrade de in den klonade gen som de ville föra in i celler i virusets genom.
De modifierade virusen kallas för virusvektorer och under 1980-talet lade forskare mycket tid och kraft på att försöka få virusvektorer att fungera och transportera gener till celler in vitro.
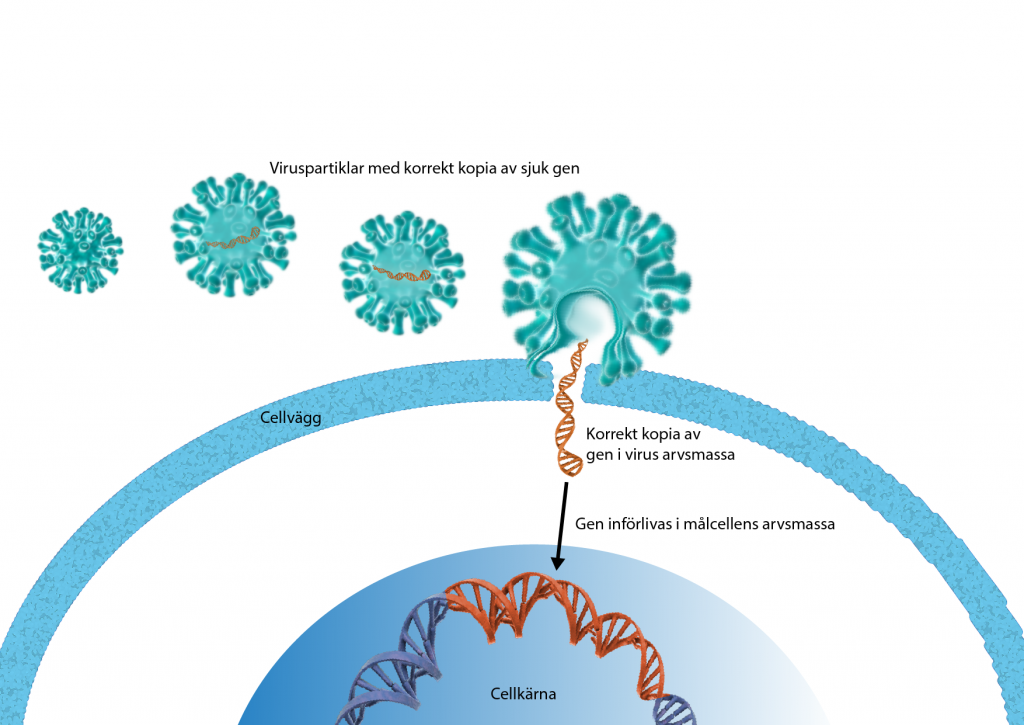
Första gången celler modifierade med virusvektorer prövas
1989 gjordes den första genöverföringen på människa. Det handlade inte om en genterapi utan syftet var att den nya genen skulle fungera som en markör för att spåra celler som getts vid en cancerbehandling. Cellerna kallas för tumörinfiltrerande lymfocyter (TIL) och modifierades ex vivo med hjälp av virusvektorer. Studien var viktig för genterapiområdet eftersom den visade att patienterna tolererade de genetiskt modifierade cellerna.
I Sverige gjordes den första genöverföringen på Huddinge sjukhus 1995. Även i denna studie var syftet att ”märka” celler med en markörgen för att forskarna skulle kunna spåra cellerna. Genen fördes in ex vivo i celler med hjälp av en virusvektor.
1990-talet, genterapier prövas men är ännu inte tillräckligt effektiva eller säkra
1990 behandlades den första patienten med genterapi. Patienten led av en typ av svår kombinerad immunbrist som förkortas SCID-ADA. Sjukdomen orsakas av mutationer i genen ADA och SCID står för engelskans Severe Combined Immune Deficiency. Konsekvenserna av mutationer i ADA är en brist på ett enzym som är viktigt för att immunförsvaret ska utvecklas normalt.
Ingen bestående behandlingseffekt
Med genterapin fick patienten en ny fungerande ADA-gen som resulterade i att patientens immunförsvar under en period blev bättre men den positiva behandlingseffekten avtog med tiden. Förmodligen följde inte den nya genen med när cellerna delade sig vilket gick emot själva idén med genterapi som en engångsbehandling.
Tre år senare lyckades forskare få effekten av samma genterapi att bestå under fyra år innan en ny behandling behövdes.
I Sverige gavs den första genterapin 1998 till sju patienter med kardiovaskulär sjukdom. Celler modifierades med en ny gen med hjälp av en plasmid (inte en virusvektor) som injicerades till hjärtmuskeln.
Kroppen kan reagera på virusvektorn
Under 1990-talet utvecklades vektorer ur fler virus, bland andra adenovirus och lentivirus som modifierades för att de inte skulle trigga patientens immunförsvar och orsaka sjukdom. 1999 kom ett stort bakslag för forskningsfältet när en ung patient avled efter att ha mottagit genterapi på grund av en kraftig immunologisk reaktion mot den virusvektor som användes.
Efter dödsfallet startade en debatt om riskerna med genterapi och berörda myndigheter blev mer restriktiva med att utfärda tillstånd för kliniska prövningar. De forskare som arbetade vidare med att utveckla genterpier fokuserade nu i mångt och mycket på att utveckla säkrare virusvektorer.
2000-talet, fler bakslag och lärdomar
År 2000 kom så det stora genombrottet som visade att genterapi fungerade och att effekten kan vara bestående. Återigen var det en typ av svår kombinerad immunbrist som var i fokus, men en sort som kallas för SCID-X1. Efter genterapin fick patienterna ett normalt fungerande immunförsvar och effekten höll i sig.
Virusvektorn kan aktivera cancergener
Studien ansågs länge vara den succé som forskningsfältet väntat på, men tyvärr fick historien skrivas om några år senare. Vid en uppföljningskontroll visade det sig att två av tio patienter som fått genterapin vid en klinik i Frankrike utvecklat cancer.
Anledningen visade sig vara att delar den virusvektor som använts vid genterapin fogats in i genomet på ett sätt så att onco-gener aktiverats. Det är en grupp gener som stimulerar celldelning och en ökad aktivitet kan leda till att friska celler omvandlas till cancerceller som delar sig okontrollerat.
Den virusvektor som användes var adenovirus som mycket sällan inkorporeras i genomet.
2010-talet genterapier når den europeiska marknaden
Redan 2003 blev Kina först i världen med att godkänna en genterapi för en cancerform som drabbar huvud och hals. Det var inte en klassisk genterapi där patientens egna celler tillförs en ny gen, utan ett så kallat onkolytiskt virus, ett modifierat virus som söker upp och dödar cancerceller. Genterapin hette Gendicine och godkändes aldrig inom EU.
Sju genterapier godkänns inom EU
Det dröjde nästan ett årtionde, till 2012, innan en genterapi godkändes för första gången av EU:s läkemedelsverk, European Medicinal Agency (EMA). Genterapin hette Glybera och var utvecklad för en mycket ovanlig sjukdom och togs bort från marknaden efter några år på grund av att så få använde den. Ytterligare sex genterapier godkändes av EMA innan tideräkningen slog över i 2020-tal.
I USA dröjde det ändå till 2017 innan Luxturna blev den första genterapin att godkännas. Luxturna är utvecklad för behandling av ögonsjukdomen retinaldystrofi och används idag även inom EU och i Sverige.
Genterapi som cancerbehandling – CAR-T-cellterapier
2012 användes för första gången en genterapi för att behandla cancer. Behandlingen kallas för CAR-T-cellterapi och är också en form av immunterapi eftersom immunceller modifieras genetiskt och riktas mot cancerceller. Den genetiska modifieringen går ut på att T-celler (ofta patientens egna) utrustas med en ny artificiell yt-receptor som kallas för chimär antigen receptor (CAR). En CAR är designad att känna igen cancerceller och riktar en immunrespons mot sjukdomen.
2015 gavs en CAR-T-cellterapi för första gången i Sverige inom ramen för en klinisk prövning i ett samarbete mellan Akademiska sjukhuset i Uppsala och Karolinska universitetssjukhuset.
2018 godkändes den första CAR-T-cellterapin, Kymriah, av EMA för behandling av akut lymfatisk leukemi. Sedan dess har många fler CAR-T-cellterapier godkänts.
2020-talet, många kliniska prövningar av genterapier pågår
Nu, mer än 50 år sedan de första tankarna om genterapi formulerades, har tekniken och kunskapen nästan hunnit ifatt de förhoppningar som fanns då. Utvecklingen av genterapier har verkligen tagit fart, det sker en ökning i antalet godkända behandlingar och runtom i världen pågår ett stort antal kliniska prövningar av nyutvecklade genterapier.
Länge låg fokuset på de ”enkla måltavlorna” det vill säga monogena sjukdomar som orsakas av mutationer i en gen. Men nu utvecklas i rask takt även CAR-T-cellterapier för behandling av olika former av cancer och även behandlingar som baseras på genomredigering med tekniker som CRISPR/Cas9.
Ett tjugotal genterapier är godkända inom EU. Bland dessa finns till exempel en fungerande genterapi för SCID-ADA som till skillnad från den som testades 1990 ger en bestående effekt och inte riskerar att orsaka cancer. Det finns även en genterapi som använder CRISPR/Cas9-teknik.
Mer information om vilka genterapier som bedömts som säkra och effektiva av EU:s Läkemedelsverk EMA (European Medicinal Agency) finns på sidan Godkända genterapier.
Uppdaterad: 2024-05-28
